新規細胞間シグナル伝達システムCD47-SHPS-1系の機能
(細胞工学 vol.23, No.5, 2004)
Physiological Functions of a Novel Cell-cell Signaling System, the CD47-SHPS-1 System.
大西 浩史、岡澤 秀樹、的崎 尚
Hiroshi Ohnishi, Hideki Okazawa, Takashi Matozaki
要旨
膜蛋白質SHPS-1は細胞内領域のチロシンリン酸化依存的にチロシンホスファターゼSHP-2と相互作用し細胞内チロシンリン酸化シグナルを制御する。一方でSHPS-1の細胞外領域は5回膜貫通 型蛋白質CD47の細胞外領域とトランスに相互作用し、細胞間シグナル伝達システムCD47-SHPS-1系を構成する。最近の研究からCD47-SHPS-1系が多様な細胞機能を主に負に制御することが明らかになってきた。
Key words: 細胞間相互作用、イムノグロブリンスーパーファミリー、SHPS-1、CD47、細胞運動、マクロファージ、神経細胞
はじめに
ヒトでは成人で3兆個以上の細胞により個体が形成されるとされているが、これら膨大な数の細胞は互いにシグナルを受け渡しすることにより協調的に作用しあ い、その結果 多様な生体機能が発現する。細胞間シグナルの多くはリガンドとレセプターの特異的結合により伝えられるが、その中でリガンドとレセプターの双方が細胞膜上 にある場合、その細胞間シグナルは細胞同士の直接の接触により伝達される。このようなシグナル伝達系は多くの細胞の中から標的細胞を限定して作用を与える のに効率的な機構であり、そのリガンドとレセプターは細胞接着活性をもつ分子である場合も多い。私共の研究グループでは、これまで蛋白質のチロシンリン酸 化を介する細胞内シグナル伝達系に関する研究を継続してきているが、その過程においてチロシンホスファターゼSHP-2 と結合するレセプター型膜蛋白質SHPS-1 を見い出している1)。SHPS-1は細胞内領域でSHP-2と相互作用する一方で、細胞外領域は生理的なリガンドである別 のレセプター型分子CD47と新しい細胞間シグナル伝達システム(CD47-SHPS-1系)を構成し、これが神経系や免疫系を始めとする様々な組織・器 官において重要な役割を果 たすことが明らかにされつつある。本稿ではこのCD47-SHPS-1系の生理機能について私共の研究成果 を含めて最近の知見を紹介したい。 I. SHPS-1とチロシンホスファターゼSHP-2 細胞質型チロシンホスファターゼであるSHP-2は、そのN末端側にリン酸化チロシン残基と特異的に結合する機能ドメインSrcホモロジー2ドメイン (SH2ドメイン)を2つもつ2)(図1A)。SHP-2は、増殖因子の刺激によりチロシンリン酸化を受けたアダプター分子IRS-1やGab-1に SH2ドメインを介して結合し、この結合によりSHP-2の作用部位 と考えられる細胞膜近傍にリクルートされると同時に活性化を受け、インスリンなどの増殖因子刺激によるRas低分子量 G蛋白質の活性化をポジテイブに制御する3)。また、別の低分子量G蛋白質Rhoについては活性化を抑制的に制御し4)、細胞の増殖、接着、運動をコント ロールする多機能なシグナル分子として機能している(図1B)。このSHP-2 の結合蛋白質として発見された膜貫通型蛋白質がSHPS-1(SHP Substrate-1)である1)。SHPS-1は、そのN末端側から3個の免疫グロブリン様構造をもつ細胞外領域、細胞膜貫通 領域、さらにリン酸化を受ける複数のチロシン残基を含む細胞内領域の3つの領域からなる膜蛋白質である(図1C)。その後の研究により、SHPS-1は増 殖因子やインテグリンを介した細胞-基質間接着による刺激によりその細胞内領域がチロシンリン酸化をうけ、このチロシンリン酸化依存的にSHP-2がその SH2ドメインを介して会合し、ホスファターゼ活性が活性化することが明らかになった1)5)。これらの成果 から、SHPS-1はIRS-1やGab-1と同様、SHP-2と相互作用しシグナル経路を構成する新たなシグナル分子であると考えられる。
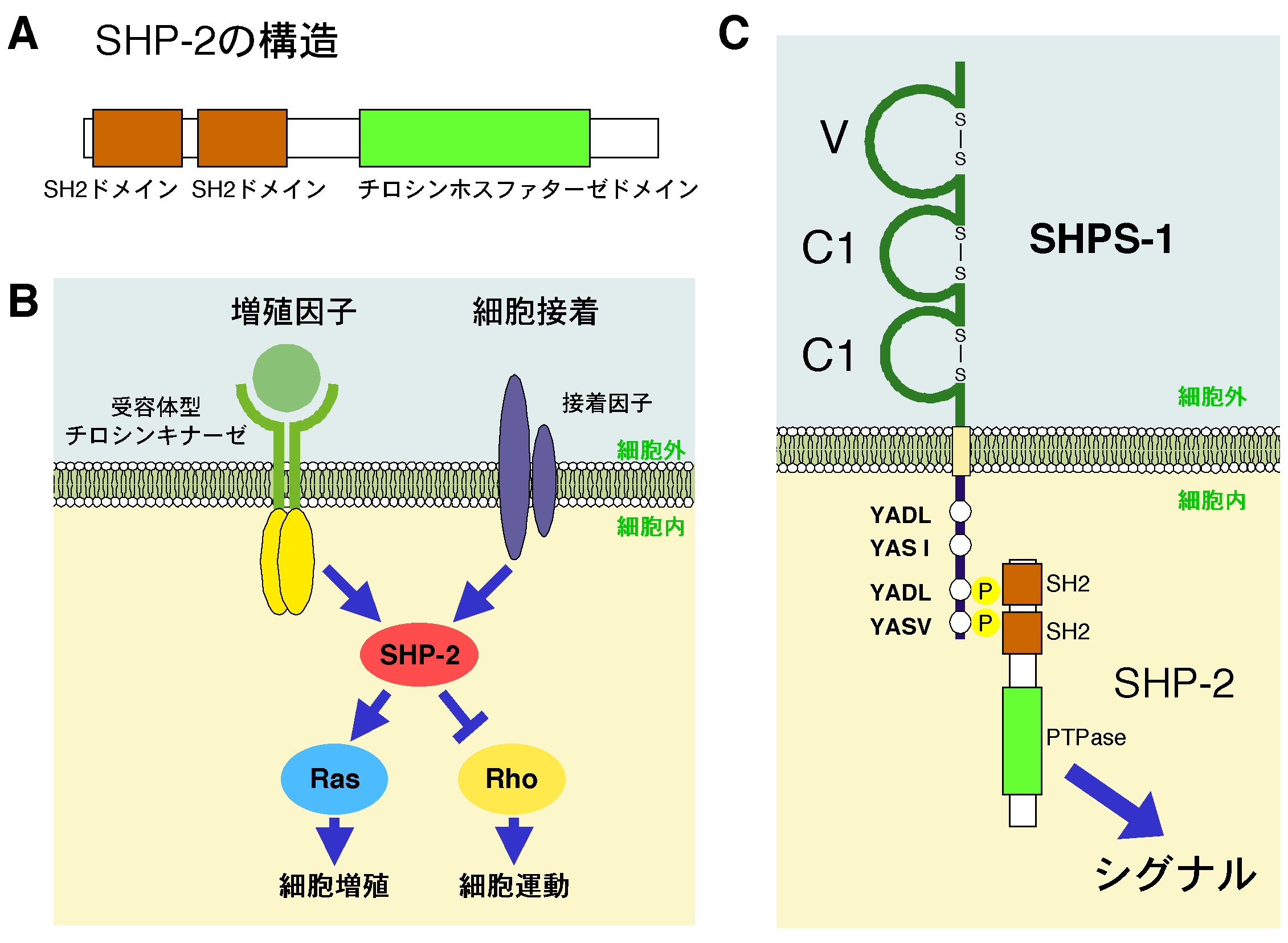
図1.SHP-2、SHPS-1の構造とその細胞内シグナル A:細胞質型チロシンホスファターゼSHP-2には、リン酸化チロシン残基と特異的に結合する機能ドメインSrcホモロジー2ドメイン(SH2ドメイン) がN末側に2つ存在し、これにチロシンホスファターゼドメインが続く。 B:SHP-2は増殖因子の刺激や細胞接着刺激に反応して、低分子量G蛋白質Rasの活性化をポジテイブに、また別 の低分子量G蛋白質Rhoについてはネガティブに制御し、細胞の増殖、運動をコントロールする。 C:膜蛋白質SHPS-1は、細胞外領域に3個の免疫グロブリン様構造(N末端からV-type, C1-type, C1-typeの免疫グロブリン様構造)をもち、細胞内領域にはリン酸化を受ける複数のチロシン残基をもつ。SHPS-1は、増殖因子や細胞-基質間の接 着による刺激に反応し、その細胞内領域がチロシンリン酸化を受け、このチロシンリン酸化依存的にSHP-2がそのSH2ドメインを介して会合し、SHP- 2のホスファターゼ活性が活性化して下流にシグナルを伝える。
II. CD47-SHPS-1系の発見
SHPS-1は、組織普遍的に発現しているが神経系と免疫系で特に強く発現する。米国ピッツバーグ大学のLagenaur らのグループは、突起伸長作用のある分子量 84 kDa の膜蛋白質を精製しp84と命名した6)。また、三菱化学生命科学研究所のSanoらのグループは、やはり神経に強く発現する高度に糖付加された膜蛋白質 としてBITを見い出していた5)。その後、p84あるいはBITの遺伝子がクローニングされ、これらの分子がSHPS-1と同一分子であることが報告さ れた7)8)。さらにLagenaurらのグループは、p84の細胞外領域の結合分子を同定し、これがやはりレセプター型の膜蛋白質であるCD47である ことを見い出した9)。すなわち、SHPS-1とCD47は各々の細胞外領域を介し相互作用することにより、全く新たな細胞間シグナル伝達系を構成するこ とが明らかとなったのである(図2)。CD47は組織普遍的に発現する5回細胞膜貫通 型の蛋白質であり、歴史的には細胞接着分子であるインテグリンに関連する分子として同定されたことから別 名IAP(Integrin-Associated Protein)とも呼ばれている10)。その細胞外領域には1個の免疫グロブリン様構造をもち、これがSHPS-1のN末端側の免疫グロブリン様構造に 結合する。
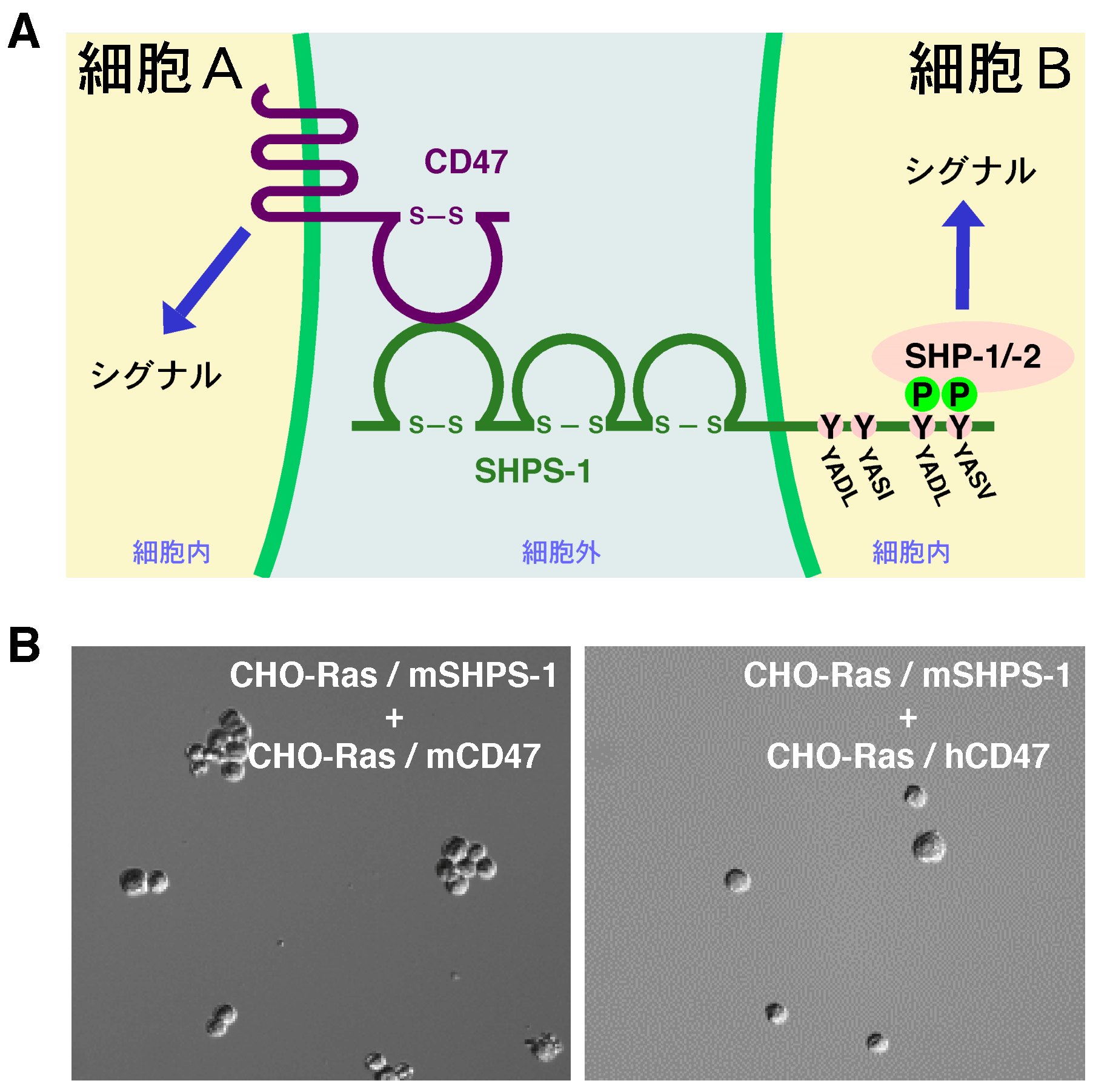
図2.CD47とSHPS-1による細胞間相互作用 A:細胞表面のSHPS-1(細胞B)は、隣接する細胞(細胞A)上のCD47とトランスに相互作用し、双方向性にシグナルを伝える細胞間シグナル伝達系 (CD47-SHPS-1系)を形成する。B:マウスCD47およびマウスSHPS-1を安定に発現する株細胞(CHO-Ras細胞)を混合すると細胞の 凝集が認められ、CD47とSHPS-1がトランスに相互作用する活性を持っていることが分かる(左図)。またヒトCD47とマウスSHPS-1を発現さ せた細胞間ではこの様な細胞凝集塊の形成は認められず、CD47とSHPS-1の相互作用が動物種に特異的であることが分かる(右図)。
III. 細胞運動とCD47-SHPS-1系
私共の研究グループでは、SHPS-1の生理機能を明らかにするためにSHPS-1の遺伝子ノックアウトマウスを作成し た。このノックアウトマウス由来線維芽細胞では低分子量 G蛋白質Rhoの活性化が障害されていると共に細胞遊走能の低下が認められる11)。この様な細胞遊走能の変化にSHPS-1とCD47の相互作用がどの ように関わるかを明らかにするため、私共はさらに、内在性にSHPS-1を発現するヒトメラノーマ細胞を用い、CD47-SHPS-1系による細胞運動の 制御について検討を行った。人工的なリガンド(リコンビナントCD47あるいはSHPS-1特異的抗体)によりメラノーマ細胞表面 SHPS-1を架橋したところ、細胞運動の有意な抑制が見られることを見出した12)(図3A-C)。さらにこの抑制作用にはSHPS-1の脱リン酸化と Rhoの活性化が関与していることを明らかにした12)。一連の解析結果 から、私共は、SHPS-1のチロシンリン酸化は下流シグナル分子SHP-2の活性化を介してRhoシグナルを抑制し、結果 として細胞運動を促進的に制御していると考えている(図3D)。リガンドであるCD47との相互作用は細胞表面 においてSHPS-1の架橋を誘導し、これによってSHPS-1の脱リン酸化が促進し、SHP-2を介したRhoの抑制が解除されることで細胞運動が負に 制御されることが考えられる。この様なCD47-SHPS-1系の働きにより、 SHPS-1を発現する細胞がCD47を発現している隣接細胞と接触した場合、その運動が効果 的に抑制されることが予測され、正常細胞で見られる接触阻害現象にもCD47-SHPS-1系が関与している可能性が考えられる。
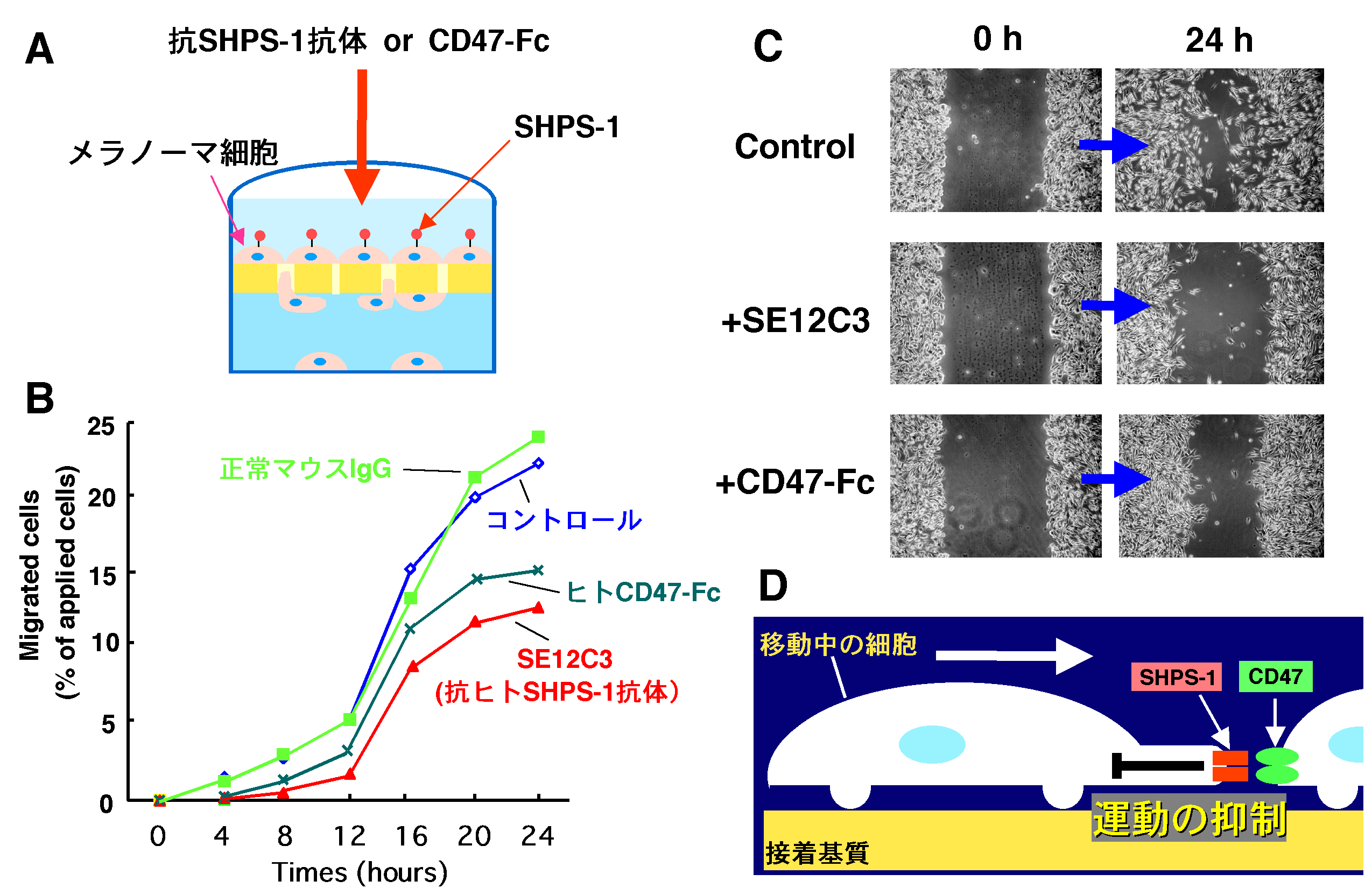
図3.CD47-SHPS-1系によるメラノーマ細胞の運動抑制 A:微小孔を持つフィルターで分けられたチャンバーの上部に細胞を加え、一定時間のうちにチャンバー下部へ移動した細胞をカウントして、細胞運動を評価し た。チャンバー上部に加える細胞を、あらかじめSHPS-1の人工的なリガンド(SHPS-1特異的抗体、あるいはヒトイムノグロブリン領域とCD47の 細胞外領域を融合させた可溶性リコンビナント蛋白質CD47-Fc)で処理し、細胞表面 SHPS-1を架橋して、細胞運動への影響を検討した。 B:なにも加えないコントロールに比べ、SHPS-1特異的抗体(SE12C3)やCD47-Fcで処理した細胞は有意に細胞運動が抑制された。正常マウ スIgGによる処理では細胞運動は影響を受けなかった。 C:コンフルエント状態にあるメラノーマ細胞の培養皿をプラスチックピペットで引っ掻いて、細胞が掻き取られた傷を作る。24時間後、細胞の移動によりこ の傷が埋められていく様子を観察し細胞運動を評価した。このアッセイ方法でも、コントロール(上図)に比べ、SHPS-1特異的抗体(SE12C3)(中 図)やCD47-Fc(下図)の存在下、有意な細胞運動の抑制が認められた。 D:CD47-SHPS-1系による細胞運動制御のモデル。移動中の細胞が隣接する細胞と接触した場合、細胞表面 のSHPS-1が隣接細胞上のCD47と出会うことでCD47-SHPS-1系が作動し、細胞運動が特異的に抑制される。正常細胞における接触阻害現象に もこのようなCD47-SHPS-1系が関与する可能性が考えられる。
IV. 免疫系におけるCD47-SHPS-1系
SHPS-1はマクロファ-ジや樹状細胞に強い発現を示す。私共の作成したSHPS-1ノックアウトマウスでは血小板数の 低下ならびに血小板寿命の短縮が認められ、これがマクロファ-ジの貪食能の亢進に起因する可能性が高いと考えられた13)。またOldenborgらは、 CD47ノックアウトマウスを用いた実験から、マクロファ-ジによる赤血球の貪食過程の制御において、赤血球膜上のCD47がマクロファ-ジ上の SHPS-1と結合することにより、脾網内系でのマクロファ-ジによる赤血球の貪食過程を負に制御することを報告している14)。私共の実験でも、 SHPS-1ノックアウトマウスにオプソニン化した赤血球を輸血すると、野生型マウスに比して急速に血流中から排除され、またSHPS-1ノックアウトマ ウスから単離した腹腔マクロファージでは、オプソニン化赤血球の貪食能が亢進していた(岡澤ら;未発表データ)。これらの結果 から、CD47-SHPS-1系は少なくともマクロファ-ジにおいては、その貪食能の負の調節に寄与すると考えられる。一方で、最近Nagataらの研究 グループは、マクロファージや未成熟樹状細胞によるアポトーシス細胞の貪食過程においては、貪食細胞上のSHPS-1と標的細胞上のCD47の相互作用が 重要であり、CD47-SHPS-1系は貪食細胞に標的細胞をつなぎ止める役割を担っていることを報告している15)。これらの結果 は、CD47-SHPS-1系が貪食作用を負に調節する機能を果たしているだけでなく、状況によって異なる生理作用を担う可能性を示している。また、マク ロファージ以外の免疫細胞系においては、T細胞上のCD47が、樹状細胞上のSHPS-1と相互作用することにより互いの細胞機能を負に調節することも報 告されている16)。このような免疫系におけるCD47-SHPS-1系の機能には、少なくともSHPS-1の細胞内領域に会合するSHP-2のもう1つ のファミリーメンバーであるSHP-1チロシンホスファターゼが関与することが示唆されているが、CD47あるいはSHPS-1より発信される細胞内シグ ナルにつては不明な点が多く、その解明は今後の重要な研究課題である。以上のようなCD47-SHPS-1系について機能解析を進める一方で、私共は SHPS-1のファミリー分子SIRPβの機能解析にも取り組んでいる。SIRPβはSHPS-1と高い相同性を示す膜蛋白質であるが細胞内領域をほとん ど持たず、代わりに膜貫通 領域と細胞内領域からなる膜蛋白質DAP-12と複合体型受容体を形成する。SIRPβについてはヒトでcDNAの報告がある以外はほとんど知見はなかっ たが、最近私共は、マウス腹腔マクロファージに発現するSIRPβが貪食を促進的に制御することを見出している(林ら;投稿中)。SIRPβのリガンドは まだ不明であるが、SIRPβとそのリガンドで形成される細胞間相互作用は、CD47-SHPS-1系と同様、貪食を始めとする様々な細胞機能制御に関わ る新たな細胞間シグナルシステムとして機能する可能性が考えられる。 V. 神経系におけるCD47-SHPS-1系 中枢神経系はSHPS-1の発現が最も強い組織であり、リガンドであるCD47も中枢神経系で強く発現している。両者とも、特に神経細胞において強い発現 を示すことからCD47-SHPS-1系は神経機能を制御する細胞間相互作用シグナルであると考えられるが、現在、神経系におけるCD47-SHPS-1 系の生理機能はほとんど明らかにされていない。私共はSHPS-1、CD47共に生後直後には発現量 が低く、神経系の成熟に伴って増加するという結果を得ており、成熟した脳神経系におけるCD47-SHPS-1系の機能に注目している。組織化学的解析で はCD47とSHPS-1は共にシナプス部位 に共局在することが報告されており17)、また、CD47については学習依存的にラット海馬で発現誘導されることや、CD47ノックアウトマウスでは記憶 のモデルである長期増強現象(LTP)が減弱することがすでに報告されている18)19)。これらの知見から、私共は、CD47-SHPS-1系がシナプ ス可塑性を制御する新しい細胞間シグナル伝達系として機能している可能性を考えている。また一方で、発生段階ではSHPS-1の発現は比較的低いが、この 時期SHPS-1は脊髄の腹側正中部(Floor Plate)で特異的に発現している5)。Floor Plateは運動ニューロンや交叉性軸索の誘導に重要な部位 であり、SHPS-1がCD47との相互作用を介して神経回路網形成にどのように関与するのか興味深い。これに関連して、最近私共はCD47の機能につい て、神経芽細胞腫由来N1E-115細胞を用いた解析を進め、N1E-115細胞においてCD47は、インテグリン、低分子量 G蛋白質Racを介して神経様突起伸長を促進する機能を持つことを見出した。また一方、N1E-115上のCD47をリコンビナントSHPS-1で刺激す るとフィロポディア形成を促進し、この作用には別 の低分子量G蛋白質Cdc42が関与していることを見出している(宮下ら;投稿中)。このようにCD47-SHPS-1系は双方向性にシグナルを伝えるこ とで、各々を発現している神経細胞の形態変化を制御し神経回路網形成に関与している可能性が考えられる。 以上のように、CD47-SHPS-1系は神経高次機能や神経回路網形成などの多様な神経機能との関与している可能性が考えられる。また最近、SHPS- 1は糖鎖を認識する複合体型ユビキチンリガーゼSkp1-Cullin1-Fbx2-Rbx1 (SCFFbx2)と相互作用し、ユビキチン化による品質管理を受けることが明らかとなった20)。SHPS-1と相互作用するFbx2はSHPS-1と 同様、神経系で特に強く発現しており、神経系におけるSHPS-1の機能はSCFFbx2によるユビキチン化により制御を受けていることが考えられる。今 後、神経系におけるCD47-SHPS-1系の生理機能とその制御機構について、様々な側面 から解析を展開することが重要であり、CD47-SHPS-1系を通して新たな神経機能制御機構が明らかになると期待している。
おわりに
本稿では、私共が見い出している新しい細胞間シグナル伝達システムCD47-SHPS-1系につき紹介した。SHPS-1 とCD47は共に組織普遍的に発現しており、神経系や免疫系以外においても多様な細胞機能に関与している可能性が想定される。今後、さらに様々な領域の研 究者がCD47-SHPS-1系の研究に参加されることを期待している。
文献
- Fujioka Y, et al: Mol Cell Biol (1996) 16: 6887-6899
- Neel BG, et al: Trends Biochem Sci (2003) 28: 284-293
- Noguchi T, et al: Mol Cell Biol (1994) 14: 6674-6682
- Kodama A, et al: Mol Biol Cell (2000) 11: 2565-2575
- Ohnishi H, et al: J Biol Chem (1996) 271: 25569-25574
- Chuang W, et al: Dev Biol (1990) 137: 219-232
- Comu S, et al: J Neurosci (1997) 17: 8702-8710
- Sano S, et al: FEBS Lett (1997) 411: 327-334
- Jiang P, et al: J Biol Chem (1999) 274: 559-562
- Brown EJ, et al: Trends Cell Biol (2001) 11: 130-135
- Inagaki K, et al: EMBO J (2000) 19: 6721-6731
- Motegi S, et al: EMBO J (2003) 22: 2634-2644
- Yamao T, et al: J Biol Chem (2002) 277: 39833-39839
- Oldenborg PA, et al: Science (2000) 288: 2051-2054
- Tada K, et al: J Immunol (2003) 171: 5718-5726
- Latour S, et al: J Immunol (2001) 167: 2547-2554
- Mi ZP, et al: J Comp Neurol (2000) 416: 335-344
- Huang AM, et al: J Neurosci (1998) 18: 4305-4313
- Chang HP, et al: Learn Mem (1999) 6: 448-457
- Murai-Takebe R, et al: J Biol Chem (2003) in press






